Investigadores descubren que una proteína epigenética regula el crecimiento, la capacidad de infección y la producción de toxinas del hongo Fusarium verticillioides, una amenaza silenciosa para los cultivos de maíz.
¿Qué es la epigenética y por qué importa?
La epigenética es el conjunto de mecanismos que regulan la actividad de los genes sin modificar la secuencia del ADN. Es decir, no cambia la «letra» del genoma, pero sí decide qué genes se activan y cuáles se mantienen apagados. Esta regulación funciona como un sistema de interruptores moleculares que encienden o silencian genes según el contexto. En organismos como los hongos, estos mecanismos pueden determinar si un gen asociado a la producción de toxinas o a la capacidad de infectar una planta se expresa o no.
Uno de los mecanismos epigenéticos más conocidos es la modificación de proteínas llamadas histonas, que ayudan a compactar el ADN. Cuando ciertas marcas químicas se agregan a las histonas, pueden reorganizar la estructura del ADN y hacer que ciertas regiones queden «cerradas» e inaccesibles para la maquinaria celular, silenciando así los genes allí contenidos.
Un hongo problemático
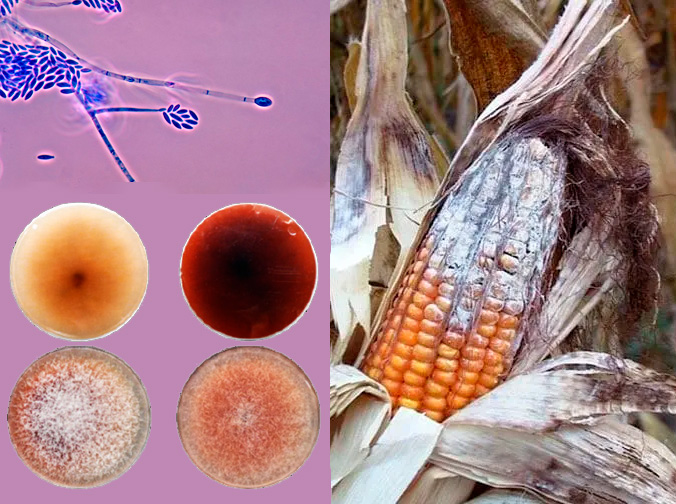
Fusarium verticillioides es un hongo muy común en los suelos agrícolas y especialmente en los cultivos de maíz. Puede comportarse como un inofensivo habitante interno de la planta (endófito), pero también puede volverse patógeno y provocar enfermedades como la podredumbre del tallo y de las espigas. Además, produce fumonisina B1 (FB1), una toxina que contamina los granos y representa un riesgo para la salud humana y animal. De hecho, se calcula que las pérdidas por este hongo pueden llegar al 30% o incluso más en zonas severamente afectadas.
Una proteína clave: FvHP1
En una investigación reciente, un equipo de científicas y científicos de Argentina y España, del cual participaron especialistas del IMBIV, CONICET-UNC, identificó en Fusarium verticillioides una proteína de la familia HP1 (proteína heterocromatina 1), a la que llamaron FvHP1. Esta proteína reconoce marcas epigenéticas específicas, conocidas como grupos metilo, en la histona H3, que participa en la organización y compactación del ADN dentro del núcleo celular. Estas marcas, o metilación, ayudan a mantener ciertos genes silenciados, especialmente los que están ubicados cerca de los extremos de los cromosomas, donde suelen encontrarse genes asociados a la producción de compuestos secundarios como pigmentos o toxinas.
Para estudiar su función, los investigadores eliminaron el gen que produce FvHP1 y compararon el comportamiento del hongo mutante con uno normal. Los resultados fueron sorprendentes.
Cuando el control epigenético se pierde
Sin FvHP1, el hongo creció más lentamente, produjo menos esporas y perdió gran parte de su capacidad para infectar plantas de maíz. Las semillas tratadas con el hongo mutante crecieron igual que las no infectadas, y las lesiones en las hojas fueron mucho menores.
Además, el hongo sin FvHP1 produjo mucha menos FB1, lo que demostraría que la proteína es un regulador positivo de la producción de esta toxina: cuando está presente, los genes responsables de fabricar fumonisina están activos; cuando falta, esos genes se silencian o se expresan menos. De cualquier manera, FvHP1 no es la única responsable para que eso suceda. La producción de FB1 responde a muchos componentes ambientales y está bajo el control de varios factores de transcripción (FT) específicos y generales a nivel celular. En este trabajo se descifra que, además de dichos FTs que actúan directamente sobre la región reguladora de la expresión génica, también existen mecanismos epigenéticos dependientes de FvHP1, una de las proteínas responsables de compactar o descomprimir la cromatina.
Pero el efecto no terminó ahí. Al perder el control epigenético, el hongo mutante empezó a producir grandes cantidades de pigmentos rojizos, que se acumularon tanto en las colonias en placas como en los cultivos líquidos. Entre esos pigmentos se identificaron varios compuestos llamados naftoquinonas, algunos de los cuales no habían sido nunca antes detectados en esta especie.
¿Para qué sirve todo esto?
Este trabajo aporta nuevas pistas sobre cómo los hongos regulan comportamientos clave como el crecimiento, la producción de toxinas y la capacidad de enfermar plantas. Entender cómo funciona este «control epigenético» abre la posibilidad de diseñar estrategias para bloquear los genes peligrosos sin necesidad de matar al hongo.
Además, el hallazgo de nuevos pigmentos en el hongo mutante podría tener aplicaciones en industrias como la farmacéutica o la alimentaria, ya que muchas naftoquinonas tienen propiedades anticancerígenas, antibacterianas, antifúngicas, antiparasitarias o se utilizan como tintes naturales.
Artículo científico original: Jacquat, A. G., Podio, N. S., Cañizares, M. C., Velez, P. A., Theumer, M. G., Areco, V. A., Garcia-Pedrajas, M. D., & Dambolena, J. S. (2025). The Growth, Pathogenesis, and Secondary Metabolism of Fusarium verticillioides Are Epigenetically Modulated by Putative Heterochromatin Protein 1 (FvHP1). Journal of Fungi, 11(6), 424. https://doi.org/10.3390/jof11060424
